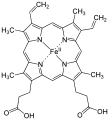
Hemo oxigenasa
 | |||||||||
| Identificadors | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Número EC | 1.14.14.18 | ||||||||
| Número CAS | 9059-22-7
| ||||||||
| Bases de dades | |||||||||
| IntEnz | IntEnz view | ||||||||
| BRENDA | BRENDA entry | ||||||||
| ExPASy | NiceZyme view | ||||||||
| KEGG | KEGG entry | ||||||||
| MetaCyc | metabolic pathway | ||||||||
| PRIAM | profile | ||||||||
| Estructures PDB | RCSB PDB PDBj PDBe PDBsum | ||||||||
| |||||||||
L'hemo oxigenasae (HO) és un enzim que catalitza la degradació del grup hemo. Aquest procés produeix biliverdina, ferro ferrós, i monòxid de carboni.[1][2]
Reacció
[modifica]L'hemo oxigenasa escindeix l'anell del grup hemo a l'enllaç alfa-metilè per formar biliverdina o, si el grup hemo està encara unit a una globina, verdoglobina. La biliverdina és més endavant convertida a bilirubina per l'acció de la biliverdina reductasa.
La reacció ocorre de la manera següent:
- Heme b + 3O₂ + 3½NADPH + 3½H+ → biliverdin + Fe2+ + CO + 3½NADP+ + 3H₂O[3]
Aquesta reacció pot ocórrer potencialment en cada cèl·lula; l'exemple clàssic és la formació d'un hematoma, el qual passa per colors diferents mentre es va curant gradualment: del vermell del grup hemo al verd de la biliverdina al groc de la bilirubina. Sota condicions fisiològiques normals, l'activitat de l'hemo oxigenasa és més alta en la melsa, on els eritròcits vells són segrestats i destruïts. En termes de mecanismes moleculars, l'enzim facilita la hidroxilació intramolecular d'un carboni meso al centre del grup hemo.[4]
Isoformes
[modifica]Es coneixen tres isoformes de l'hemo oxigenasa. L'hemo oxigenasa 1 (HO-1) és una isoforma induïble com a resposta a l'estrès com l'estrès oxidatiu, la hipòxia, la presència de metall pesants, citocines, etc. L'hemo oxigenasa 2 (HO-2) és una isoforma constitutiva que és expressada en condicions homeostàtiques. Ambdues formes són expressades en tot el cos i presenten activitat catalítica.
Una tercera hemo oxigenasa (HO-3) no té activitat catalítica, però es creu que intervé en la detecció d'oxigen.
Funcions en fisiologia
[modifica]L'expressió de l'hemo oxigenasa és induïda per l'estrès oxidatiu, i en els models animals que n'augmenten expressió sembla un mecanisme de protecció. El monòxid de carboni alliberat en les reaccions de l'hemo oxigenasa poden influir el to vascular independentment o influir la funció de l'enzim òxid nítric sintasa. Es creu que el monòxid de carboni alliberat en la reacció del grup lliure hemo en el torrent sanguini d'algú amb anèmia falciforme és cregut redueix els efectes de la malària cerebral.[5]
Referències
[modifica]- ↑ Kikuchi G, Yoshida T, Noguchi M «Heme oxygenase and heme degradation». Biochem. Biophys. Res. Commun., 338, 1, 12-2005, pàg. 558–67. DOI: 10.1016/j.bbrc.2005.08.020. PMID: 16115609.
- ↑ Ryter, Stefan W.; Alam, Jawed; Choi, Augustine M. K. "Heme oxygenase-1/carbon monoxide: from basic science to therapeutic applications" Physiological Reviews (2006), 86(2), 583-650. doi:10.1152/physrev.00011.2005
- ↑ Evans JP, Niemevz F, Buldain G, de Montellano PO «Isoporphyrin intermediate in heme oxygenase catalysis. Oxidation of alpha-meso-phenylheme». J. Biol. Chem., 283, 28, 7-2008, pàg. 19530–9. DOI: 10.1074/jbc.M709685200. PMC: 2443647. PMID: 18487208.
- ↑ Tadashi Yoshida, Catharina Taiko Migita "Focused Review Mechanism of heme degradation by heme oxygenase" Journal of Inorganic Biochemistry 2000, Volume 82, Issues 1–4, pages 33-41. doi:10.1016/S0162-0134(00)00156-2
- ↑ Danielle Morse and Augustine M. K. Choi "Heme Oxygenase-1", American Journal of Respiratory and Critical Care Medicine, Vol. 172, No. 6 (2005), pp. 660-670. doi:10.1164/rccm.200404-465SO
Enllaços externs
[modifica]- «Hemo oxigenasa» (en anglès). Medical Subject Headings. A la Biblioteca Nacional de Medicina dels EUA
- EC 1.14.99.3